Substitusi Kedua
Suatu
benzene tersubstitusi dapat mengalami substitusi gugus kedua. Beberapa benzene
tersubstitusi bereaksi lebih mudah daripada benzenanya sendiri, sementara
benzene substitusi lain lebih sukar bereaksi. Misalnya anilin bereaksi
substitusi elektrofil sejuta kali lebih cepat daripada benzene. Sebaliknya
nitrobenzene bereaksi dengan laju kira-kira seperti
Substitusi
kedua pada anilin oleh Br2 berlangsung cepat tanpa katalis daripada benzene.
Substitusi kedua pada nitrobenzene harus dengan katalis, temperature
tinggi dan waktu yang lebih lama daripada benzene.
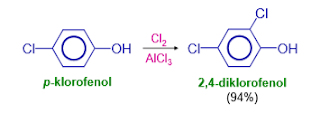
Klorobenzena
dinitrasi pada posisi orto dan para, tetapi tidak pada posisi meta. Sedangkan
nitrobezena menjalani nitrasi kedua pada posisi meta, terjadi sangat sedikit
substitusi pada posisi orto dan para. Posisi substitusi kedua
ditentukan oleh gugus yang telah berada pada cincin. Cl disebut pengarah-orto,
para, sedangkan NO2 disebut pengarah-meta.
Semua
pengarah –o,p, kecuali halogen, merupakan gugus aktivasi dan
memiliki pasangan elektron menyendiri (kecuali aril dan alkil). Gugus aktivasi
akan mendorong elektron ke cincin aromatic, menyebabkan cincin “kaya” elektron.
Adanya gugus ini menyebabkan cincin lebih terbuka (rentan;susceptible)
terhadap substitusi lebih lanjut Semua pengarah –m merupakan gugus
deaktivasi dan tidak ada yang memiliki pasangan elektron menyendiri
(unshared) yang terikat pada cincin. Gugus deaktivasi akan menarik elektron
dari cincin, menyebabkan cincin “miskin” elektron. Adanya gugus ini menyebabkan
cincin lebih tertutup terhadap serangan elektrofil (Fessenden dan
Fessenden,1982).
Jika
efek Induksi (I) positif maka substituent sebagai pendorong elektron,
begitupula sebaliknya, jika I+, maka substituent merupakan penarik elektron. Apabila
efek mesomeri/resonansi (R) positif, maka sebagai penyumbang elektron,
sedangkan jika R negative, maka sebagai penarik elektron.
Substituen pendorong atau penyumbang elektron menaikkan
rapatan elektron benzene sehingga lebih reaktif terhadap E+. Sebaliknya
substituent penarik atau pengambil elektron menurunkan rapatan
elekton sehingga benzene kurang reaktif.
Mekanisme substitusi kedua dengan pengarah –o,-p
Contoh
reaksi substitusi elektrofil yaitu reaksi nitrasi pada toluene. Berikut
merupakan mekanisme resonansi dari nitrasi toluene pada posisi orto, meta dan
para. NO2 merupakan elektrofil yang akan masuk ke toluene.
Nitrasi
toluen pada posisi orto dan para. Penyerangan pada posisi orto dan para menghasilkan
satu struktur resonansi dengan muatan positif pada cincin atom karbon yang
terikat dengan gugus metil atau karbokation tersier. Karbokation tersier
membuat kontribusi besar dalam kestabilan dari resonansi, sehingga cenderung stabil.
Jika
pada posisi meta, struktur resonansi menunjukkan muatan positif tidak terletak
pada atom karbon yang terikat gugus metil. Hanya karbokation sekunder yang
mungkin, dan kurang stabil dibandingkan karbokarion tersier.
Efek stabilisasi dari jenis
substituen dapat ditunjukkan dengan struktur resonansi. stabilisasi resonansi
langsung hanya mungkin ketika substituent orto atau para ke elektrofil yang
masuk. Dikarenakan kelompok substituen memiliki interaksi resonansi langsung
dengan muatan yang diperoleh dalam σ-kompleks, efek kuantitatif substituen
menunjukkan komponen resonansi tinggi. Persamaan hammett hanya berlaku pada posisi meta dan para, tidak pada posisi orto. Pada
posisi orto tidak berlaku Persamaan Hammett dikarenakan pada posisi orto
bertetanggaan langsung dengan substituent pertama, sehingga substituent tersebut
meruah (sterik) dan merupakan suatu halangan bagi substituent kedua yang akan
masuk. Kenapa tidak pada posisi para? Hal ini dikarenakan kestabilan cincin aromatic
yaitu pada posisi meta, sehingga posisi para kurang disukai.
Permasalahan :
- Gugus alkil tidak memiliki
pasangan elektron menyendiri yang dapat disumbangkan bagi penstabilan
secara resonansi, akan tetapi mengapa gugus alkil termasuk pengarah –o,
-p?
- Bagaimana substituen mempengaruhi laju substitusi?
- Bagaimana hubungan reaksi substitusi aromatik dengan persamaan Hammett?
Daftar Pustaka
Fessenden, R.J dan J.S. Fessenden. 1982. Organic
Chemistry Third Edition. Jakarta : Erlangga.
Hornback, J.M. 2006. Organic Chemistry Second Edition.
USA : Thomson Learning Inc.
Ouelleette, R.J dan
J.D.Rawn. 2014. Organic Chemistry : Structure, Mechanism, dan
Synthesis. San Diego : Elsevier Inc.
Subandi. 2010. Kimia Organik. Yogyakarta : Dee
Publish













6 komentar:
Terimakasih atas materinya ica:) menurut saya gugus alkil merupakan gugus aktivasi atau termasuk dalam pengaktif cincin maka dari itu akan mengarah pada pengarah orto-para
materi yang sangat mneraik saya akan menjawab pertanyaan pertama dimana CH3 merupakan gugus aktivasi yang menyebabkan cincin kaya akan elektron sehingga mengarah pada orto-para.
Terimakasih becek
Saya akan mencoba menjawab
1. Gugus metil mendonorkan elektron ke cincin, membuat intermediet lebih stabil dibandingkan karbokation sikloheksadienyl turunan dari benzene. Pembentukan produk subtitusi para dan orto dihasilkan dari stabilisasi ya ng lebih baik dibandingkan intermediet yang menghasilkan produk substitusi meta.
2. Laju dipengaruhi oleh substituen pertama dimana aktivator akan meningkatkan laju
Deaktivator akan menurunkan laju
Sekian :)
terimakasih disini untuk pertanyaan pertama yaitu CH3 merupakan gugus aktivasi yang menyebabkan cincin kaya akan elektron sehingga mengarah pada orto-para.
pengaruh aktivator pada subtituen pertama ataupun deaktivator mempengaruhi dari laju reaksi aromatiknya
Hai Becek
menurut saya, karena gugus alkil merupakan gugus pengaktivasi pengarah orto para,selain itu gugus metil mendonorkan elektron ke cincin, membuat intermediet lebih stabil. Yang kedua, yang mempengaruhi laju substitusi adalah substituen pertama, jika substituen tsb bersifat sebagai pengaktivasi maka laju akan semakin meningkat begitupun sebaliknya
terima kasih atas pemaparan materinya, menurut saya jawaban pertanyaan no 2 yaitu susbtituen gugus aktivasi memperkaya elektron pada cincin sehingga menururnkan energi aktivasi mempercepat rekasi sedangkan gugus deaktivasi mengurangi elektron pada cincin yang menurunkan laju reaksi
Posting Komentar