Menurut Bronsted-Lowry, asam merupakan substansi yang mendonorkan ion hidrogen, H+, dan basa merupakan substansi yang menerima ion H+ (akseptor). Sebagai contoh, jika HCl dalam bentuk gas dilarutkan dalam air, maka molekul polar HCl bertindak sebagai asam yang mendonorkan proton, sedangkan molekul air bentindak sebagai basa yang menerima proton. Produknya yaitu ion klorida (Cl-), dan ion hydronium (H3O+).
Ion klorida merupakan produk yang dihasilkan ketika asam klorida (HCl) kehilangan satu proton, yang disebut basa konjugasi dari asam, dan ion hydronium, produk yang dihasilkan ketika basa H2O memperoleh satu proton, yang disebut asam konjugasi dari basa. Sama halnya untuk asam mineral lainnya seperti H2SO4 dan HNO3 dan begitu pula untuk asam organic seperti asam asetat CH3COOH.
Rumus umum :
Contoh :
Air dapat bertindak sebagai asam maupun basa, tergantung keadaan. Dalam reaksi dengan HCl, air sebagai basa yang menerima proton untuk membentuk ion hydronium, H3O+. Pada reaksi dengan ammonia (NH3) dimana air sebagai asam yang mendonorkan proton untuk membentuk ion ammonium (NH4+) dan ion hidroksida (OH-) (Mc Murry, 2012).
Menurut lewis, asam lewis adalah akseptor elektron dan basa lewis merupakan donor elektron. Basa lewis merupakan pendonor sepasang elektron dan elektron tesebut diberikan ke asam lewis (akseptor elektron). Pasagan elektron bebas merupakan elektron yang biasanya didonorkan ke asam lewis.
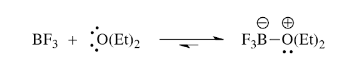
Sebagai contoh, boron trifluorida tidak akan bertindak sebagai asam lewis karena tidak ada yang memiliki kemampuan untuk mendonorkan elektron. Jika dietik eter ditambahkan, boron trifluoride etherate, sebuah kompleks stabil asam-basa lewis akan terbentuk. Sepasang elektron dari atom oksigen dietil eter dapat didonorkan ke boron trifluorida. Jika ada senyawa yang bertindak sebagai basa lewis, maka boron trifluorida akan bertindak sebagai asam lewis (Hoffman, 2004).
Asam kuat, HCl bereaksi sempurna dengan air, sedangkan asam lemah, CH3COOH, asam asetat hanya bereaksi sedikit dengan air. Kekuatan asam dalam air dideskripsikan menggunakan acidity constant (Ka). Perlu diingat dalam reaksi umum kimia, konsentrasi pelarut diabaikan dalam kesetimbangan.
Asam kuat akan menggeser kesetimbangan ke kanan dan memiliki konstanta keasaman yang lebih besar. Sedangkan asam lemah akan menggeser kesetimbangan ke kiri dan memiliki konstanta keasaman yang lebih kecil. Rentang dari nilai Ka untuk asam yang berbeda sangat besar, dari 1015 untuk asam kuat dan 10-60 untuk asam lemah.
Kekuatan asam biasanya dinyatakan dengan nilai pKa dibandingkan dengan Ka, dimana pKa adalah negative logaritma dari Ka.
Asam kuat (Ka besar) memiliki nilai pKa yang kecil, dan asam lemah (Ka kecil) memiliki nilai pKa yang besar. Pada tabel 2.3 dapat dilihat kekuatan dari asam dan basa konjugasi (McMurry, 2012).
Asam yang kehilangan proton dari karbon disebut asam karbon. Suatu karbanion adalah basa konjugasi dari asam karbon. Asam karbon merupakan asam yang sangat lemah (pKa diatas -17), lebih lemah dari asam oksigen karena karbon keelktronegatifannya lebih kecil dibandingkan oksigen. Meningkatnya jumlah gugus fenil menurunkan pKa delokalisasi muatan dalam cincin.
Elektronegatifitas dari atom karbon menurun dalam sp > sp2 > sp3, yang mana menunjukkan ethyne asam yang lebih kuat dibandingkan ethene. Dan lebih kuat dibandingkan ethane [C2H2 (pKa -26), C2H4 (pKa -44), C2H6 (pKa -50)].
Senyawa organic yang bersifat basa yaitu derivate alkil dari air dan ammonia. Contohnya alcohol (ROH), eter (ROR’), dan amina primer (RNH2). Basa mengandung atom yang memiliki minimal satu pasang elektron bebas seperti oksigen (O), nitrogen (N) dan beberapa sulfur (S). Alkohol merupakan basa lemah tetapi ion alkoksida (basa konjugasi) lebih basa. Sama halnya dengan hidroksida dan ion amida lebih basa dibandingkan air dan ammonia.
Untuk mengetahui kekuatan basa (kemampuan untuk menerima proton dari asam) dari senyawa organic dapat dinyatakan dengan Kb, dimana :
Jika dilihat dari nilai pKa dalam fase gas, eliminasi ikatan hidrogen meningkatkan kebasaan, tersier > sekunder > primer. Berikut merupakan kekuatan basa (Singh, 2007).
Daftar Pustaka
Hoffman, R.V. 2004. Organic Chemistry An Intermediate Text Second Edition. New Jersey : John Wiley & Sons Inc.
McMurry, J. 2012. Organic Chemistry Eighth Edition. Canada : Cengage Learning.
Singh, M.S. 2007. Advanced Organic Chemistry Reactions and Mechanisms. India : Pearso Education.
Pertanyaan :
1. Berdasarkan reaksi tersebut, tentukanlah asam dan basa menurut teori Bronsted-Lowry!
2. Dari kedua jenis asam amino tersebut, mana yang memiliki sifat keasaman yang lebih kuat? jelaskan!
3. Jika semakin kecil nilai pKa, maka sifat keasamannya makin kuat. Bagaimana pengaruh nilai pKb terhadap sifat kebasaan suatu senyawa?












13 komentar:
Materi yang sangat menarik yaa becek,
Menurut saya, NH4+ adalah asam karena mendonorkan ion H+ sedangkan H20 adalah basa karena menerima ion H+ dan hal ini sesuai dengan konsep bronsted lowry.
Berdasarkan nilai pka phenytalanine mrupakan asam yg kuat dibandingkan trytophan, hal ini sesuai dengan penyataan di blog anda bahwa yg memiliki nilai pka yg lbh kecil merupakan asam kuat.
hai Becek
Terimakasih atas informasi yang diberikan. Disini saya akan mencoba menjawab pertanyaan yang diberikan. Menurut saya untuk pertanyaan pertama, pada reaksi tersebut NH4+ berperan sebagai asam karena spesi ini mendonorkan protonnya menghasilkan NH3 (basa konjugasi) dan H2O berperan sebagai spesi basa yang merupakan akseptor proton membentuk H3O+ (asam konjugasi)
Sedangkan, pada pertanyaan kedua dapat diamati dari nilai pKa yang mana semakin kecil nilai pKa maka kekuatan asam nya semakin besar jadi fenilalanin lebih kuat keasamannya dibandingkan triptofan.
Terimakasih. Semoga membantu
terima kasih atas materinya. menurut saya untuk pertanyaan pertama NH4+ berperan sebagai asam yang mendonorkan proton dan H2O sebagai basa yang menerima proton. untuk pertanyaan kedua menurut saya fenilalanin lebih asam dari pada triptofan karena nilai pKa berbanding terbalik dengan keasaman
terimakasih untuk materinya.
menurut saya NH4+ sebagai pendonor proton sehingga bersifat asam dan H20 sebagai akseptor sehingga bersifat basa.
menurut saya phenylalanin lebih asam dibandingkan dengan tryptophan karena pKa phenylalanin lebih kecil dibandingkan tryptophan
Nh4 merupakan asam karena mendonorkan h+, dengan begitu air otomatis merupakan biasanya.
Dan juga fenilalanin jelas lebih asam daripada triptopan karena nilai pka yang lebih kecil
berdasarkan konsep bronsted lowry. Pada NH4+ berperan sebagai asam karena mendonorkan ion H+ sedangkan H20 berperan sebagai basa karena menerima ion H+.
Terimakasih becek
1. NH4+ (asam) dengan basa konjugasinya NH3
H2O (basa) dengan asam konjugasinya H3O+
2. Phenylalanin adalah asam lebih kuat dari triptofan yang dilihat dari pKa nya karena pKa << semakin asam
Terimakasih atas penjelasan yang saudari sampaikan, sangat bermanfaat
baiklah disini saya akan mencoba menjawab pertanyaan yang diajukan
1. NH4+ bersifat asam karena sebagai pendonor ion H+ sedangkan H2O bersifat basa karena sebagai aseptor ion H+
2. Fenilalanin memilki sifat keasaman lebih kuat dari triptofan, dapat dilihat dari pKa nya karena pKa yang semakin kecil akan bersifat lebih asam kuat
Terimakasih :)
terimakasih atas materinya
pertanyaan pertama nh4 merupakan asam karena pendonor H+
untuk pertanyaan kedua posisi dari NH3 yang lebih dekat dengan gugus karboksil lah yang mempengaruhi kenapa lebih asam dibandingkan yang lebih jauh
terimakasih atas penjelasannya..
saya akan mencoba menjawab pertanyaan anda..
menurut saya yang bertindah sebagai asam adalah NH4+ karena merupakan pendonor proton, sedangkan untuk basanya adalah H2O karena bertindak sebagai penerima
untuk pertanyaan kedua dapat dilihat berdasarkan nilai pKa dimana semakin kecil nilai pKa maka akan semakin asam sifatnya.
maaf jika jawaban saya kurang tepat
terimakasih atas penjelasan materinya menurut saya NH4 berperan sebagai pendonoh H+ dengan kata lain sebagai asam sedangkan H2O sebagai bas
Menurut saya untuk jawaban no. 2 menurut saya phenylalanine lebih asam dibandingkan tryptophan hal ini dikarenakan pada phenylalanine memiliki nilai pKa yang lebih kecil,karena semakin kecil nilai pKa maka semakin asam sifatnya
Menurut saya untuk jawaban no. 2 menurut saya phenylalanine lebih asam dibandingkan tryptophan hal ini dikarenakan pada phenylalanine memiliki nilai pKa yang lebih kecil,karena semakin kecil nilai pKa maka semakin asam sifatnya
Posting Komentar